Fatores Que Influenciam A Velocidade Das Reações Químicas Exemplos: Mergulhe no fascinante mundo da cinética química, onde exploraremos os fatores cruciais que governam a velocidade das reações químicas. Prepare-se para uma jornada esclarecedora repleta de exemplos elucidativos, explicações científicas sólidas e insights abrangentes.
Concentração dos reagentes

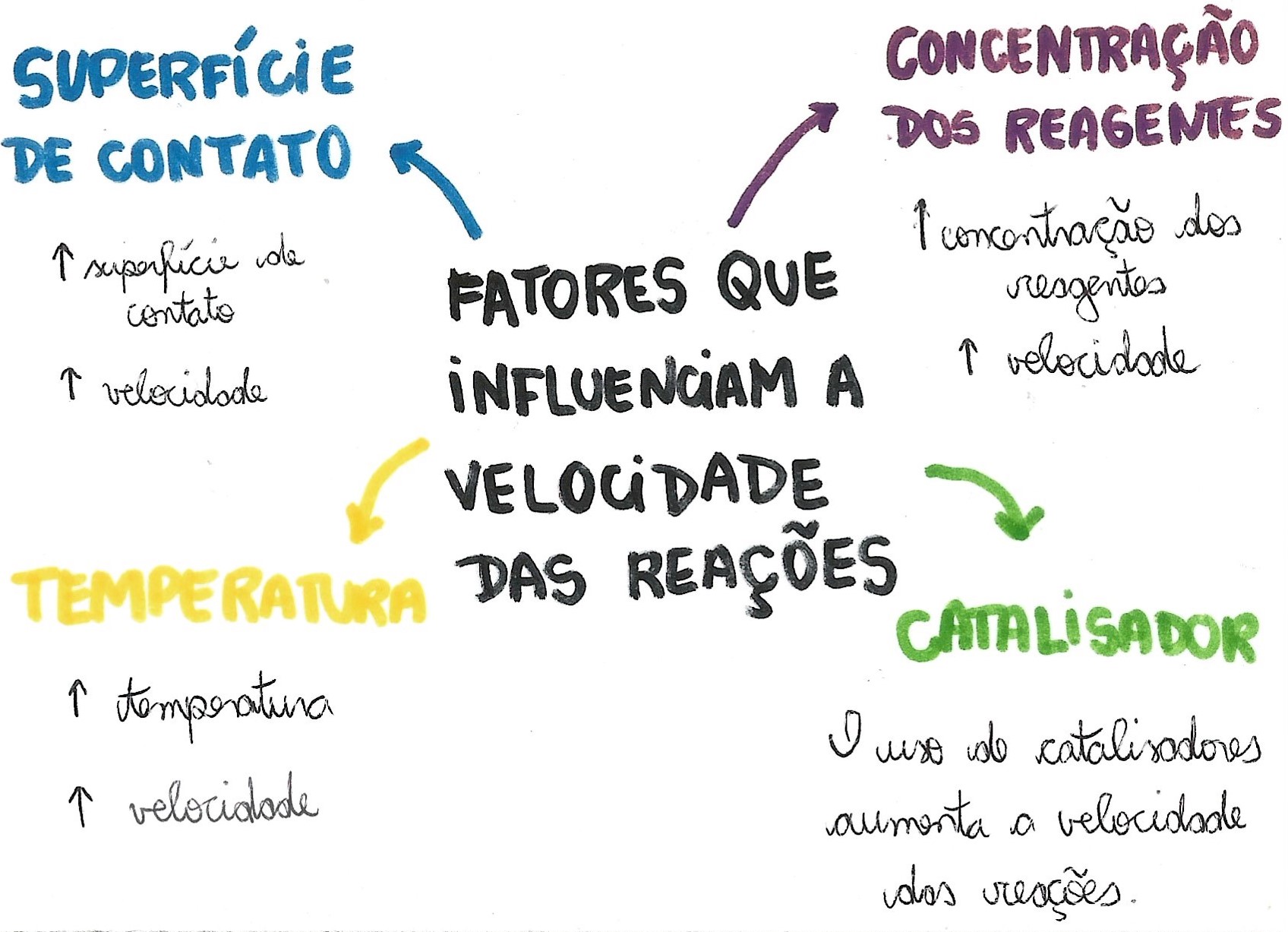
A concentração dos reagentes é um fator crucial que influencia a velocidade das reações químicas. Quanto maior a concentração dos reagentes, maior a probabilidade de colisões entre eles, resultando em uma velocidade de reação mais rápida.
Ordem de reação
A ordem de reação é um conceito que descreve como a velocidade da reação varia em relação à concentração dos reagentes. É determinada experimentalmente e representa o número de moléculas de reagente envolvidas na etapa determinante da velocidade da reação.
Por exemplo, uma reação de primeira ordem tem uma velocidade que é diretamente proporcional à concentração de um reagente, enquanto uma reação de segunda ordem tem uma velocidade que é proporcional ao quadrado da concentração de um reagente.
Variação da velocidade com a concentração
Matematicamente, a variação da velocidade da reação com a concentração pode ser expressa pela equação da taxa:“`Velocidade = k[A]^m[B]^n“`Onde:* k é a constante de velocidade
- [A] e [B] são as concentrações dos reagentes A e B
- m e n são as ordens de reação em relação a A e B, respectivamente
Esta equação mostra que a velocidade da reação é proporcional às potências das concentrações dos reagentes, de acordo com suas ordens de reação.
Temperatura
A temperatura desempenha um papel crucial na velocidade das reações químicas. Quanto maior a temperatura, mais rápido as moléculas se movem e colidem, resultando em uma maior probabilidade de reações bem-sucedidas.
A teoria das colisões explica o efeito da temperatura sobre a velocidade da reação. Segundo essa teoria, as moléculas precisam colidir com energia suficiente (energia de ativação) para que a reação ocorra. A temperatura mais alta aumenta a energia cinética das moléculas, aumentando a probabilidade de elas possuírem energia de ativação suficiente para reagir.
Tabela: Relação entre Temperatura e Velocidade da Reação
| Temperatura (K) | Velocidade da Reação (M/s) |
|---|---|
| 298 | 0,1 |
| 313 | 0,2 |
| 328 | 0,4 |
| 343 | 0,8 |
Área de superfície dos reagentes

A área de superfície dos reagentes é um fator crucial que afeta a velocidade das reações químicas. Quanto maior a área de superfície, mais moléculas de reagente estarão disponíveis para colidir e reagir, levando a uma velocidade de reação mais rápida.Um
exemplo clássico é a reação entre um comprimido de carbonato de cálcio e ácido clorídrico. Quando o comprimido é inteiro, a área de superfície disponível para a reação é relativamente pequena, resultando em uma reação lenta. No entanto, se o comprimido for triturado em pó, a área de superfície aumenta drasticamente, aumentando a velocidade da reação.
Área de superfície ativa
A área de superfície ativa é a parte da superfície do reagente que está realmente disponível para a reação. Fatores como porosidade e rugosidade podem aumentar a área de superfície ativa, aumentando a velocidade da reação.Por exemplo, o carvão ativado tem uma área de superfície ativa muito grande devido à sua estrutura porosa.
Isso o torna um adsorvente eficaz, pois pode adsorver uma grande quantidade de substâncias em sua superfície.
Presença de catalisadores: Fatores Que Influenciam A Velocidade Das Reações Químicas Exemplos

Os catalisadores são substâncias que aumentam a velocidade das reações químicas sem serem consumidos no processo. Eles atuam fornecendo um caminho alternativo de reação com menor energia de ativação, o que facilita a quebra das ligações químicas e a formação de novos produtos.
Existem dois tipos principais de catalisadores: homogêneos e heterogêneos.
Catalisadores homogêneos
Os catalisadores homogêneos estão na mesma fase que os reagentes, geralmente em solução. Eles formam complexos intermediários com os reagentes, o que reduz a energia de ativação da reação. Um exemplo de catalisador homogêneo é o íon H+ na reação de inversão da sacarose.
Catalisadores heterogêneos
Os catalisadores heterogêneos estão em uma fase diferente dos reagentes, geralmente sólidos. Eles fornecem uma superfície sobre a qual as reações podem ocorrer. A eficiência dos catalisadores heterogêneos depende da área de superfície, porosidade e natureza química da superfície.
Um exemplo de catalisador heterogêneo é a platina na reação de conversão catalítica.
Fatores que afetam a eficiência do catalisador, Fatores Que Influenciam A Velocidade Das Reações Químicas Exemplos
A eficiência de um catalisador é afetada por vários fatores, incluindo:
- Natureza do catalisador: A natureza química e a estrutura do catalisador influenciam sua capacidade de interagir com os reagentes e fornecer um caminho alternativo de reação.
- Concentração do catalisador: A concentração do catalisador afeta a taxa de reação até que a superfície do catalisador esteja saturada com reagentes.
- Temperatura: A temperatura afeta a energia cinética dos reagentes e a capacidade do catalisador de interagir com eles. A temperatura ideal para uma reação catalisada varia de acordo com o catalisador e a reação específica.
Polaridade do solvente
A polaridade do solvente é uma medida da capacidade do solvente de dissolver substâncias iônicas ou polares. Os solventes polares têm uma distribuição desigual de carga, com uma extremidade positiva e outra negativa. Os solventes apolares, por outro lado, têm uma distribuição uniforme de carga e não possuem pólos positivos ou negativos distintos.
A polaridade do solvente afeta a velocidade da reação porque pode influenciar a solvatação dos íons ou moléculas polares. A solvatação é o processo pelo qual as moléculas de solvente se orientam ao redor dos íons ou moléculas polares, formando uma camada de solvente ao redor deles.
Essa camada de solvente reduz a interação entre os íons ou moléculas polares, diminuindo assim a velocidade da reação.
Solventes polares
Os solventes polares, como água, etanol e metanol, têm uma alta constante dielétrica, o que significa que podem separar cargas opostas com facilidade. Esses solventes solvatam fortemente íons e moléculas polares, reduzindo a velocidade das reações entre eles.
Solventes apolares
Os solventes apolares, como hexano, benzeno e éter dietílico, têm uma baixa constante dielétrica e não podem separar cargas opostas com facilidade. Esses solventes solvatam fracamente íons e moléculas polares, tendo pouco efeito na velocidade das reações entre eles.
Influência na velocidade da reação
A polaridade do solvente pode influenciar a velocidade da reação de várias maneiras:
- Para reações que envolvem íons, solventes polares diminuem a velocidade da reação solvatando os íons e reduzindo sua interação.
- Para reações que envolvem moléculas polares, solventes polares podem aumentar ou diminuir a velocidade da reação, dependendo da natureza da reação.
- Para reações que envolvem moléculas apolares, solventes polares geralmente têm pouco efeito na velocidade da reação.
Influência no equilíbrio químico
A polaridade do solvente também pode influenciar o equilíbrio químico de uma reação. Em uma reação de equilíbrio, a posição do equilíbrio pode ser deslocada para o lado dos reagentes ou produtos, dependendo da polaridade do solvente. Isso ocorre porque a polaridade do solvente pode alterar a solubilidade dos reagentes e produtos, bem como a velocidade das reações diretas e reversas.
Concluindo, a velocidade das reações químicas é um fenômeno multifacetado influenciado por uma constelação de fatores. Compreender esses fatores é essencial para otimizar processos químicos, prever comportamentos de reações e projetar experimentos eficazes. Ao dominar este conhecimento, os cientistas e pesquisadores podem desbloquear novas possibilidades no campo da química e além.

