Propriedades Coligativas: Quais São, Resumo, Exemplos – Mundo Educação. Já se perguntou como a adição de sal à água afeta seu ponto de ebulição? Ou como o anticongelante funciona em seu carro? A resposta está nas propriedades coligativas, fenômenos que dependem apenas da concentração de partículas de soluto, e não de sua identidade. Vamos explorar os quatro tipos principais – tonoscopia, ebulioscopia, crioscopia e pressão osmótica – desvendando seus princípios, aplicações no dia a dia e na indústria, e os fatores que influenciam sua magnitude.
Prepare-se para mergulhar nesse universo fascinante da química!
Compreender as propriedades coligativas é fundamental para diversas áreas, desde a fabricação de alimentos e medicamentos até processos industriais complexos. A tonoscopia, por exemplo, explica a diminuição da pressão de vapor de um solvente na presença de um soluto não volátil. Já a ebulioscopia e a crioscopia revelam, respectivamente, o aumento do ponto de ebulição e a diminuição do ponto de congelamento de um solvente quando um soluto é adicionado.
A pressão osmótica, por sua vez, é crucial em processos biológicos, como a absorção de água pelas raízes das plantas e a regulação hídrica em nosso corpo. Ao longo deste texto, vamos detalhar cada uma dessas propriedades, mostrando como elas estão presentes em nosso cotidiano e na indústria.
Conceitos Fundamentais das Propriedades Coligativas: Propriedades Coligativas: Quais São, Resumo, Exemplos – Mundo Educação
As propriedades coligativas são propriedades físicas de uma solução que dependem apenas da concentração do soluto e não da sua identidade. Em outras palavras, elas são afetadas pelo número de partículas de soluto presentes na solução, e não pela natureza química dessas partículas. Isso significa que soluções com a mesma concentração molar de diferentes solutos apresentarão as mesmas propriedades coligativas, desde que o soluto não seja volátil e não sofra dissociação ou associação significativa no solvente.
A compreensão dessas propriedades é crucial em diversas áreas, da química analítica à biologia e engenharia.
Definição e Tipos de Propriedades Coligativas
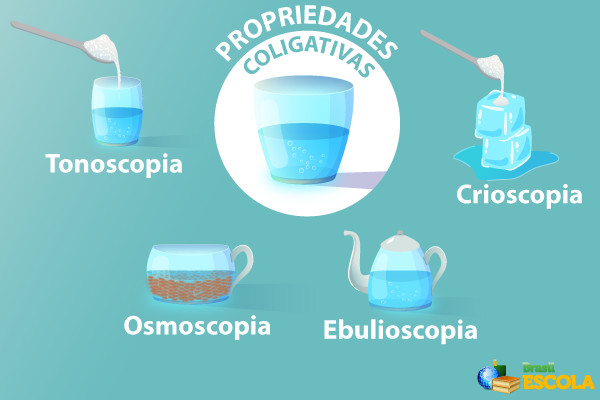
As propriedades coligativas são: tonoscopia, ebulioscopia, crioscopia e pressão osmótica. A tonoscopia refere-se ao abaixamento da pressão de vapor do solvente quando um soluto não volátil é adicionado. A ebulioscopia descreve a elevação do ponto de ebulição do solvente. A crioscopia trata do abaixamento do ponto de congelamento do solvente. Por fim, a pressão osmótica é a pressão necessária para impedir a passagem de solvente através de uma membrana semipermeável de uma solução menos concentrada para uma mais concentrada.
Comparação e Contraste das Propriedades Coligativas
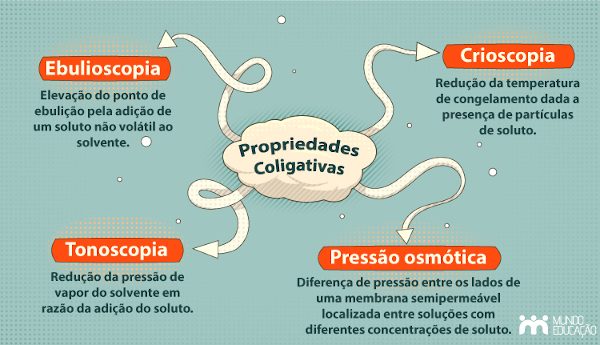
As quatro propriedades coligativas, apesar de distintas em suas manifestações, compartilham a característica fundamental de dependerem da concentração do soluto. Todas elas resultam da diminuição da tendência do solvente em escapar da fase líquida, seja para a fase gasosa (tonoscopia), seja para a fase sólida (crioscopia), ou para outra solução (osmose). A diferença reside no aspecto específico do comportamento do solvente que é afetado.
A tonoscopia afeta a pressão de vapor, a ebulioscopia o ponto de ebulição, a crioscopia o ponto de congelamento e a pressão osmótica o fluxo de solvente através de uma membrana. Em soluções diluídas, o efeito de cada propriedade é diretamente proporcional à concentração molar do soluto.
Tabela Resumindo as Propriedades Coligativas
| Propriedade | Definição | Fórmula (para soluções diluídas) | Exemplo | Efeito no Ponto de Ebulição/Congelamento |
|---|---|---|---|---|
| Tonoscopia | Abaixamento da pressão de vapor do solvente. | ΔP = Xsoluto
|
Adição de sal à água reduz sua pressão de vapor. | Afeta indiretamente: o abaixamento da pressão de vapor leva à elevação do ponto de ebulição e abaixamento do ponto de congelamento. |
| Ebulioscopia | Elevação do ponto de ebulição do solvente. | ΔTe = K e – m | Água com sal ferve a uma temperatura ligeiramente superior à água pura. | Eleva o ponto de ebulição. |
| Crioscopia | Abaixamento do ponto de congelamento do solvente. | ΔTc = K c – m | Água com sal congela a uma temperatura ligeiramente inferior à água pura. | Abaixa o ponto de congelamento. |
| Pressão Osmótica | Pressão necessária para impedir a osmose. | π = M R T | A pressão osmótica em células vegetais mantém a turgidez. | Afeta indiretamente: a pressão osmótica influencia o equilíbrio de solvente entre soluções, impactando indiretamente os pontos de ebulição e congelamento em sistemas abertos. |
Aplicações das Propriedades Coligativas no Cotidiano e na Indústria
As propriedades coligativas, que dependem apenas do número de partículas de soluto e não da sua natureza, têm aplicações vastas e importantes em nosso dia a dia e em diversos processos industriais.
Compreender essas aplicações permite apreciar a relevância dessas propriedades na ciência e na tecnologia. A seguir, exploraremos alguns exemplos concretos de sua utilização.
Aplicações Cotidianas das Propriedades Coligativas
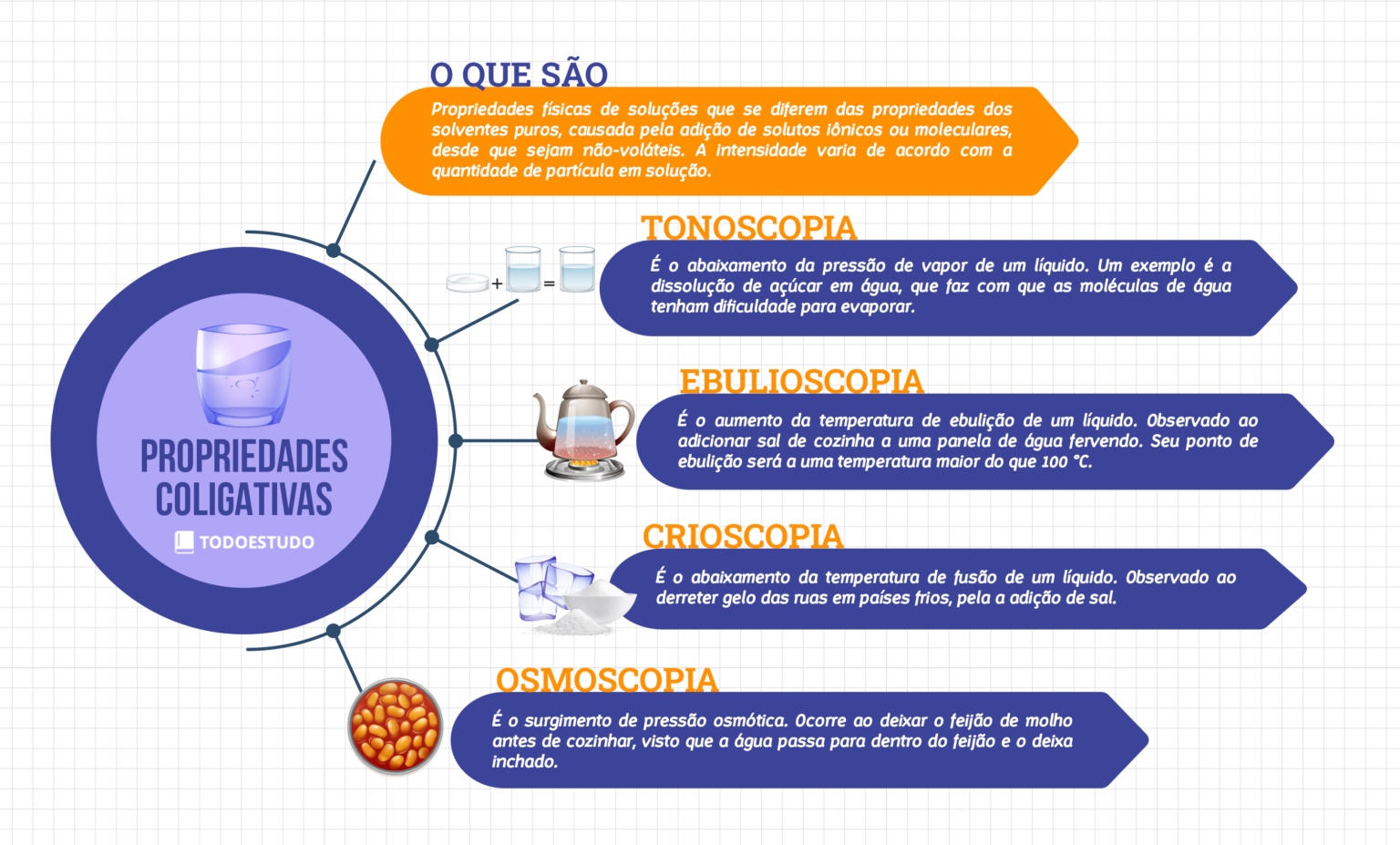
A adição de sal à água utilizada para cozinhar macarrão, o uso de anticongelante em automóveis e a conservação de alimentos por meio de soluções salinas ou açucaradas são exemplos cotidianos que demonstram a influência das propriedades coligativas. No primeiro caso, a adição de sal aumenta o ponto de ebulição da água, fazendo com que a água ferva a uma temperatura superior a 100°C, acelerando o cozimento.
Já o anticongelante, geralmente uma solução aquosa de etilenoglicol, reduz o ponto de congelamento da água, impedindo que o líquido congele no radiador do carro, mesmo em temperaturas abaixo de zero. Por fim, a conservação de alimentos em soluções concentradas de sal ou açúcar, como picles ou compotas, ocorre devido à diminuição da atividade da água, dificultando o crescimento microbiano.
Aplicações Industriais das Propriedades Coligativas
A indústria se beneficia significativamente das propriedades coligativas em diversos processos. Dois exemplos notáveis são a osmose reversa e a crioscopia. A osmose reversa é amplamente utilizada na dessalinização da água do mar, onde a aplicação de alta pressão reverte o fluxo osmótico, separando o sal da água. Este processo é crucial para garantir o acesso à água potável em regiões áridas e costeiras.
A crioscopia, por sua vez, encontra aplicação na indústria alimentícia, onde a determinação do ponto de congelamento de soluções é utilizada para controlar a concentração de solutos em alimentos processados, como sorvetes e geléias, garantindo a qualidade e a textura desejadas.
Importância da Pressão Osmótica na Fisiologia Humana e na Osmose Reversa
A pressão osmótica desempenha um papel fundamental em diversos processos biológicos e industriais.
- Fisiologia Humana: A pressão osmótica regula a distribuição de água entre os compartimentos intracelular e extracelular, mantendo a homeostase. Desequilíbrios na pressão osmótica podem levar a problemas de saúde graves, como desidratação ou edema. O transporte de nutrientes e a excreção de resíduos também são influenciados pela pressão osmótica.
- Osmose Reversa: Na osmose reversa, a aplicação de uma pressão superior à pressão osmótica força a passagem do solvente através de uma membrana semipermeável, separando o soluto do solvente. Essa técnica é essencial na dessalinização da água, purificação de efluentes e concentração de sucos de frutas.
Fatores que Influenciam as Propriedades Coligativas
As propriedades coligativas, como o abaixamento da pressão de vapor, a elevação ebuliométrica, o abaixamento crioscópico e a pressão osmótica, são propriedades físicas que dependem exclusivamente do número de partículas de soluto presentes na solução, e não da natureza química dessas partículas. Entretanto, alguns fatores influenciam a magnitude dessas propriedades, afetando diretamente a intensidade do efeito coligativo observado.A magnitude das propriedades coligativas é diretamente afetada por dois fatores principais: a natureza do soluto e a concentração da solução.
Solutos que se dissociam em mais partículas em solução, como sais iônicos, causam um efeito maior do que solutos que permanecem como moléculas intactas. Já a concentração, como esperado, influencia diretamente a intensidade da alteração nas propriedades do solvente. Quanto maior a concentração de soluto, maior será a alteração nas propriedades coligativas.
Efeito da Volatilidade do Soluto
A volatilidade do soluto desempenha um papel crucial na influência das propriedades coligativas, particularmente na pressão de vapor. Solutos voláteis contribuem para a pressão de vapor total da solução, reduzindo a diferença entre a pressão de vapor da solução e a do solvente puro. Em contrapartida, solutos não-voláteis não contribuem para a pressão de vapor da solução, levando a um abaixamento mais pronunciado da pressão de vapor em comparação com soluções contendo solutos voláteis.
Um exemplo claro disso é a diferença observada no abaixamento da pressão de vapor entre uma solução de sacarose (não-volátil) e uma solução de etanol (volátil) em água, na mesma concentração molar. A solução de sacarose apresentará um abaixamento maior na pressão de vapor.
Influência da Dissociação Iônica na Magnitude das Propriedades Coligativas, Propriedades Coligativas: Quais São, Resumo, Exemplos – Mundo Educação
A dissociação iônica de um soluto afeta significativamente a magnitude das propriedades coligativas. Solutos iônicos, ao se dissolverem em água, dissociam-se em íons, aumentando o número total de partículas na solução. Esse aumento no número de partículas intensifica o efeito coligativo. Por exemplo, o cloreto de sódio (NaCl) dissocia-se em dois íons (Na⁺ e Cl⁻) em solução aquosa.
Uma solução 0,1 mol/L de NaCl terá um efeito duas vezes maior nas propriedades coligativas do que uma solução 0,1 mol/L de glicose (um soluto não-iônico que não se dissocia).
A magnitude da elevação ebuliométrica, por exemplo, é diretamente proporcional ao número de partículas de soluto presentes na solução. Uma solução de um composto iônico que se dissocia completamente em dois íons produzirá uma elevação ebuliométrica duas vezes maior que uma solução de um composto não-iônico na mesma concentração.
Considere uma solução 0,1 mol/L de NaCl e uma solução 0,1 mol/L de sacarose. A solução de NaCl, devido à dissociação em íons Na⁺ e Cl⁻, terá efetivamente uma concentração de partículas de 0,2 mol/L. Isso resultará em um abaixamento da pressão de vapor, uma elevação ebuliométrica e um abaixamento crioscópico maiores do que na solução de sacarose, que permanece como uma molécula indivisa.
O fator de van’t Hoff (i) é utilizado para levar em conta o efeito da dissociação iônica. Para eletrólitos fortes, i é aproximadamente igual ao número de íons formados pela dissociação de uma fórmula unitária do composto. Para eletrólitos fracos, i é menor que o número de íons esperados, devido à dissociação incompleta.
Para ilustrar, uma solução 1 molal de NaCl (i ≈ 2) apresentará uma elevação ebuliométrica aproximadamente duas vezes maior que uma solução 1 molal de ureia (i = 1), um soluto não-iônico. Essa diferença é atribuída à maior concentração efetiva de partículas na solução de NaCl devido à dissociação iônica.
Em resumo, as propriedades coligativas são fenômenos químicos essenciais para entendermos uma variedade de processos, desde o funcionamento do nosso corpo até a produção industrial de diversos produtos. Compreender a influência da concentração de soluto, a natureza do soluto e a dissociação iônica na magnitude dessas propriedades é crucial para dominar seus princípios. De exemplos cotidianos, como o uso de sal para cozinhar ou de anticongelante no inverno, a aplicações industriais complexas, como a osmose reversa na dessalinização da água, as propriedades coligativas demonstram sua importância em diversas áreas do conhecimento.
Esperamos que este resumo tenha proporcionado uma visão clara e abrangente sobre este tema tão relevante da química.

